| Физико-химические методы изучения макромолекул | |
| Автор: student | Категория: Естественные науки / Химия | Просмотров: 4800 | Комментирии: 0 | 05-01-2014 14:03 |
Физико-химические методы изучения макромолекул
Основной задачей биофизики, биохимии, молекулярной биологии, генетики и ряд других смежных дисциплин является изучение живых систем на молекулярном уровне. Решение этой задачи невозможно без использования самых разных методов физико-химической биологии. В современной биологии используется большое количество физических, химических, математических методов исследований. В последние годы разработаны сложные физико-химические методы, позволяющие детально охарактеризовать биологические системы, в т.ч. на молекулярном уровне. В этой лекции дается обзор наиболее широко используемых в биологических исследованиях физико-химических методов.
Спектроскопические методы. Абсорбционная спектрофотометрия.
Для исследования свойств биологических систем и макромолекул широко применяют различные спектроскопические (спектральные, оптические) методы, т.е. методы, основанные на взаимодействии молекул со светом. Оптические методы используются для изучения стационарных характеристик биологических объектов, когда за время измерения не происходит изменений регистрируемых параметров. Они также используются для измерения и динамических параметров, изменяющихся во времени в процессе их регистрации, вследствие протекания в системе нестационарных процессов.
Световая (электромагнитная) волна представляет собой колебания электрического и магнитного полей во взаимно перпендикулярных плоскостях, амплитуды колебания которых по мере распространения волны изменяются по синусоиде (рис.1). Энергия волны
Е = hc/l = hn,
где h - постоянная Планка, с - скорость света, l - длина волны, n - частота волны.
Рис. 1. Схематичное изображение световой (электромагнитной)волны. (Фрайфельдер, 384 с)
Когда световая волна сталкивается с молекулой, она может либо преломляться (т.е. изменять направление распространения), либо поглощаться (т.е. энергия волны передается молекуле). Относительная вероятность протекания того или иного процесса является свойством той молекулы, с которой произошло столкновение. Если произошло поглощение электромагнитной энергии, о молекуле говорят, что она возбуждена или перешла в возбужденное состояние. Поглощение и излучение энергии световой волны происходит определенными порциями, квантами. Интенсивность излучения светового потока I = nE (n - число квантов в световом потоке). Энергия кванта связана с длиной волны (нм) следующими соотношениями: EДж = 1,2 108/l, EэВ = 1234/l, где Eдж выражена Дж/моль, EэВ - в электрон-вольтах.
Молекула или часть молекулы, которая может быть возбуждена при поглощении света в видимой области или УФ-области, называется хромофором. В основном, энергия возбуждения превращается в тепло (кинетическую энергию) в результате столкновения возбужденной молекулы с другой молекулой (например, с молекулой растворителя). При возбуждении некоторых типов молекул поглощенная энергия света вновь излучается в виде фотонов (флоуресценция). В любом случае, интенсивность света, прошедшего через молекулу, содержащую набор хромофоров, меньше интенсивности падающего света. Как известно, молекула (атом) характеризуется набором квантованных энергетических состояний, описываемых законами квантовой механики. Эти состояния называют энергетическими уровнями молекул (атомов). Главный энергетический уровень определяется возможным пространственным распределением электронов и называется электронным энергетическим уровнем. Внутри главного уровня находятся колебательные уровни, характеризующие изменение движения электронов. Колебательные уровни указывают на различные типы колебаний молекул (изменение угла связей, длины связей). Энергетические уровни молекул обычно изображают схемой энергетических уровней (Рис. 2 ). Самый низкий электронный уровень называют основным состоянием молекулы (атома), а все другие – возбужденными состояниями.
Рис.2. Схема энергетических уровней молекулы (Фрайфельдер,385)
1- основной (S0) электронный уровень 2 - первый возбужденный (S1*) уровень; 3- колебательные уровни; 4- переход с основного уровня на колебательный уровень возбужденного состояния. 5- переход с одного колебательного уровня на другой в пределах одного состояния.
Наибольшая вероятность поглощения энергии электромагнитной волны имеет место в случае, если эта энергия соответствует разности энергий квантованных состояний молекулы. Электромагнитная волна (свет) с длиной волны l поглощается в том случае, если
l = hc/Е2 – Е1,
где Е1 - значение энергии молекулы до возбуждения (основной энергетический уровень), Е2 - значение энергии возбужденной молекулы ( после поглощения энергии электромагнитной волны).
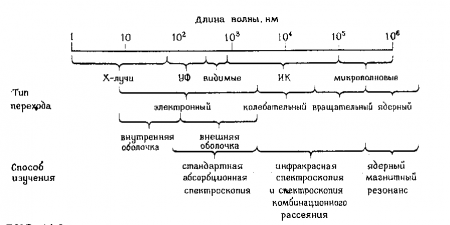
Изменение энергетического состояния молекулы при поглощении (или испускании) энергии света называется переходом. Переход между электронными уровнями соответствует энергии, необходимой для перемещения электрона с одного уровня на другой. При переходе электрона на более высокий энергетический уровень энергия поглощается, при переходе на более низкий уровень – энергия излучается. Зависимость между поглощением энергии молекулой от длины волны падающего света называется спектром поглощения. Поскольку возможны переходы с основного состояния на любой колебательный или вращательные уровни, то спектр поглощения молекулы выглядит в виде относительно плавной кривой. Каждый тип молекул характеризуется своим, присущим только этой молекуле, спектром поглощения. Для большинства биологических молекул, длины волн, соответствующие переходам между основным состоянием и любым колебательным уровнем первого возбужденного состояния, лежат в ультрафиолетовой и видимой части спектра ( 102 -103 нм) ( Рис. 7 ). Возможны также переходы между колебательными уровнями в пределах одного электронного уровня. Такие переходы имеют место в результате поглощения излучения в инфракрасной области спектра (103 - 105 нм). Переходы на вращательном уровне (изменения спина электрона) происходят в области радиочастотного спектра электромагнитных волн ( >105 нм).
Рис. 3. Схема спектра электромагнитных волн и использование различных спектральных методов анализа макромолекул.(Фрайфельдер, 386 с)
Вероятность поглощения света определенной длины волны молекулами характеризуется молярным коэффициентом поглощения ( погашения, экстинции) e. Если световой поток с интенсивностью I0 проходит через раствор с толщиной слоя d и концентрацией молекул с, то интенсивность прошедшего через раствор света I подчиняется закону Ламберта-Бэра
I = I0 ×10-edc
или
lgI/I0=-e×dc
или
lgI0/I=e×dc ,
где I – интенсивность света (энергия на единицу плащади в единицу времени), Дж×м2× с; e - молярный коэффициент поглощения (погашения, экстинции), характеризует вероятность перехода молекулы из одного энергетического состояния в другое при поглощении или испускании кванта света;
d - толщина слоя раствора ( длина кюветы), см;
с - концентрация вещества, моль/л.
Результаты измерений выражают либо как процент пропускания , либо как поглощение . Когда d = 1см, А называют оптической плотностью Dl = ec. Индекс l указывает на длину волны, при которой проводится измерение. При высоких концентрациях вещества в растворе могут иметь место отклонения от закона Ламберта-Бэра. Это может происходить вследствие рассеяния света, структурных изменений молекул (например, при димеризации, агрегации молекул). Высокие концентрации веществ в растворе могут стимулировать и химические изменения молекул. Поэтому при спектрофотометрическом определении концентрации вещества в растворе, нужно убедиться в соблюдении этого закона в исследуемом интервале концентраций. Например, в случае соблюдения закона, разбавление исследуемого раствора в 2 раза, должно привести к уменьшению значения Dl тоже в 2 раза.
Измерение поглощения света осуществляется при помощи спектрофотометров или фотоколориметров. Несмотря на различия в конструкции, все спектрофотометры (рис.8) состоят из источника света (1), монохроматора (2), стеклянной кюветы (3), куда помещается исследуемый образец, детектора света (4) и измерительного прибора (5). Ход работы обычно следующий. Прибор настраивают таким образом, чтобы он показывал нулевое значение при измерении поглощения растворителя, в котором растворено исследуемое вещество. Затем можно снимать показания, соответствующие непосредственно поглощению образца. Для получения спектра поглощения операция повторяется при различных длинах волн.

Рис. 4. Схематичное изображение устройства спектрофотометра. (фрайфельдер,388)
- источник света (вольфрамовая или дейтериевая лампа);
- монохроматор;
- кюветная камера с кюветой;
- фотоэлемент (детектор света);
- измерительный прибор.
Абсорбционная спектофотометрия широко используется для определения концентрации вещества, анализа химических реакций, идентификации веществ, определения структурных параметров макромолекул.
Определение концентрации растворов проводят непосредственно измерением оптической плотности, если известен e и соблюдается закон Ламберта-Бэра. В большинстве случаев для определения концентрации используют калибровочные графики, составленные по известным концентрациям.
- Исследование биохимических реакций. Скорость реакции, активность ферментов можно измерить по уменьшению концентрации субстрата или по повышению концентрации продукта реакции в реакционной смеси.
- Идентификация веществ путем спектральных измерений. Большинство соединений имеют характерные спектры поглощения и могут быть идентифицированы с их помощью. Для этих целей используются автоматические регистрирующие спектрофотометры.
- Исследование процессов денатурации и ренатурации ДНК. При денатурации ДНК его оптическая плотность D260, при ренатурации – понижается
Инфракрасная спектрофотометрия
При поглощении света в ИК-области спектра (103 – 105 ) происходят переходы между колебательными уровнями основного состояния молекулы (Рис. ). Спектр поглощения инфракрасного света возникает за счет характеристических движений (изменение длины, величины угла связей) различных функциональных групп (например, метильной, амидной, карбонильной и.т.д). Колебательные спектры очень чувствительны к изменениям химической структуры, конформации, окружения молекулы. В этом смысле инфракрасная спектроскопия не отличается от спектрофотометрии в видимом и ультрафиолетовом свете. И сами ИК-спектрофотометры принципиально не отличаются спектрофотометров, работающих в области видимого и ультрафиолетового света. Этот метод рассматривается отдельно ввиду того, что имеются некоторые отличия методологического характера.
ИК-спектрофотометр состоит из источника излучений ( металлический стержень, нагретый до 1800 – 2000 С(, монохраматора, кюветной камеры с кюветой, детектора излучений (термопара). Главная трудность использования ИК-спектрофотометра для характеристики макромолекул состоит в том, что нельзя использовать их водные растворы. Вода имеет очень высокий показатель теплоемкости , соответственно, характеризуется высоким коэффициентом поглощения ИК-спектра . По другому, водная среда почти полностью поглощает инфракрасный свет. Поэтому спектры поглощения макромолекул , находящихся в водном растворе, полностью затушевываются растворителем. Для изучения макромолекул в ИК-спектрофотометре используют метод сухих пленок. Сухие пленки получают выслушиванием концентрированных растворов на поверхности пластинок. Конечно, необходимо иметь в виду, что структура макромолекулы в сухой пленке существенно отличается от таковой в растворе. Вследствие этого ограничения, ИК-спектрофотометрия пока не нашла такого широкого применения в биологических исследованиях, как спектрофотометрия в видимом и ультрафиолетовом свете. При изображении спектров поглощения в ИК- свете не длина волны λ , а частота ν или волновое число 1/ ν.
Применение инфракрасной спектрофотометрии:
- Определение относительного содержания α-спирали, β-структур, беспорядочного клубка в белках по интенсивности амидных полос.
- Установление количества водородных связей и функциональных групп, участвующих в образовании водородных связей в макромолекулах.
- Изучение процессов денатурации и ренатурации молекул белков и НК по изменению числа
водородных связей.
- Определение относительного содержания А-Т (У) и Г-Ц в молекулах нуклеиновых кислот.
- Изучение взаимодействия между небольшими молекулами, например, белка с лигандом, фермента с ингибитором и т.д.
Флуоресцентная спектроскопия
Флуоресцентные методы исследования являются более чувствительным, чем поглощающая спектроскопия. Термином флуоресценция обозначают испускание кванта видимого или УФ-света возбужденной молекулой, при переходе электрона с возбужденного синглетного уровня на основной уровень (S* ® S0 ). Возбужденное состояние молекулы при поглощении квантов электромагнитной волны, является неравновесным, и молекула быстро возвращается в основное состояние. Время нахождения электронов на возбужденных синглетных уровнях составляет 10-8 – 10-9 с. За это время электрон переходит на основной уровень, излучая энергию в виде тепла (инфракрасное излучение) или в виде квантов видимого или УФ-света (флуоресценция) (рис. 13). При соударениях возбужденной молекулы с соседними молекулами возможна переориентация спина возбужденного электрона, и он переходит на триплетный Т* уровень. Триплетное состояние электронов является более стабильным, чем синглетное. Время нахождения электронов на триплетном уровне может составить несколько часов. Переход электрона с возбужденного триплетного уровня на основной (Т* ® S0 ) также может сопровождаться испусканием квантов света. Это явление называется фосфоресценцией.
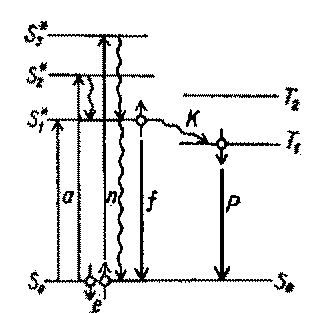
Рис.5. Схематичное изображение процессов флуоресценции и фосфоресценции(Костюк,81с)
S – синглетные уровни; Т- триплетные уровни; 1 –поглощение энергии (S0 -S1* переход); 2- флуоресценция (S1*- S0 переход); 3- фосфоресценция ( Т1*- S0 переход );
4 – безизлучательный переход .
Флуоресценция и фосфоресценция зависят от типа молекул и от их окружения. Интенсивность флуоресценции изменятся в зависимости от длины волны возбуждающего света. Спектр флуоресценции – зависимость интенсивности флуоресценции от длины волны испускаемого света. Спектр возбуждения – зависимость флуоресценции описывается квантовым выходом Q – отношением числа излученных квантов nf к числу поглощенных квантов na :
Q = nf /na
Интенсивность флуоресценции измеряют на приборах - спектрофлуориметрах. На рисунке 14 показана стандартная схема прибора для измерения флуоресценции. Во многом, устройство спектрофлуориметра сходно с устройством поглощающего спектрофотометра. Свет высокой интенсивности проходит через монохрамотор, поглощается веществом в прозрачной кювете. Так как излучаемые флуоресцирующим веществом лучи испускаются во всех направлениях, то светочувствительный детектор установлен перпендикулярно направлению падающего луча. Это исключает измерение интенсивности проходящего через кювету падающего света. При флуоресцентном анализе макромолекул используются два типа флуоресцирующих хромофоров: флуоресцирующие группировки в составе самих молекул и внесенные флуоресцирующие хромофоры, связанные с компонентами макромолекул (флуоресцентная метка).

Рис. 6. Схема устройства спектрофлуориметра. ( Фрайфельдер, 419 с)
1. источник света; 2 – монохраматор возбуждающего света; 3 – возбуждающий свет; 4 – кювета с образцом; 5 – прошедший свет; 6 – испускаемый свет; 7 – монохраматор испускаемого света; 8 – детектор света.
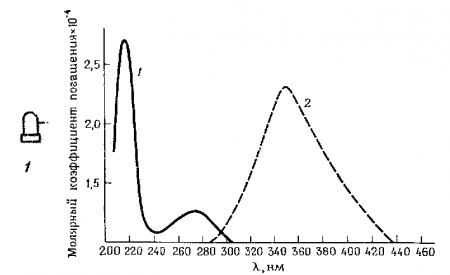
Собственная флуоресценция белков. В составе белковых молекул содержатся три флуоресцирующих хромофора – остатки тирозина, триптофана и фенилаланина. Наиболее интенсивной флуоресценцией характеризуются триптофан и тирозин. Например, в водном растворе спектр возбуждения триптофана лежит в области длин волн от 200 до 300 нм, спектр флуоресценции – от 300 до 440 нм с lfmax = 353 нм (Рис.15). Квантовый выход Q = 0.13 и время жизни t = 3,1 нс.
Рис.7. Спектры поглощения (возбуждения) и флуоресценции триптофана в водном растворе (Фрайфельдер, 417 с. )
1– спектр поглощения; 2 - спектр флуоресценции.
Интенсивность флуоресценции и другие параметры ( lfmax , Q, t) остатков аминокислот и сильно зависят от микроокружения (от типа растворителя, рН –раствора, присутствия других молекул или соседних групп в составе полипептида). Поэтому измерение флуоресценции дает ценную информацию об конформации белковых молекул. Для интерпретации данных собственной флуоресценции белков пользуются эмпирическими правилами и закономерностями, полученных при изучении модельных соединений с хорошо известной структурой и конформацией.
Флуоресцентные метки и зонды. Для исследования методом флуоресценции в изучаемую молекулу связывают с флуоресцирующим хромофором. Такой способ исследования получил название «метод флуоресцентных меток (зондов)». Для исследования белковых молекул в качестве таких меток используют 1-анилин-8-нафталинсульфонат-анион , 1-ДИМЕТИЛАМИНОНАФТАЛИН-5-СУЛЬФОНАТ-АНИОН, РОДАМИН, флуоресцин. В качестве меток для нуклеиновых кислот используются акридиновый оранжевый, профлавин, акрифлавин, этидийбромид. Соединение, используемое в качестве флуоресцентной метки, должно удовлетворять следующим критериям: 1) хорошо должно связываться с определенным участком исследуемой молекулы; 2) его флуоресценция должна быть чувствительна к изменению условий окружения; 3) оно не должно оказывать влияние на свойства исследуемой макромолекулы.
Дисперсия оптического вращения и круговой дихроизм
В основе этих методов лежит одно и то же физическое явление: взаимодействие поляризованного света с оптически активными молекулами. Как известно, все биологические молекулы являются оптически активными, т.е. способными вращать плоскость поляризации при прохождении через них поляризованного света. Все молекулы, содержащие ассиметричный атом углерода являются оптически активными. Как отмечалось выше, свет – электромагнитная волна, состоящая из осциллирующих электрического и магнитного полей. Вектор колебания электрического Е и вектор магнитного Н поля взаимно перпендикулярны. Плоскость поляризации определяется как плоскость колебания вектора Е. Обычный, неполяризованный свет представляет собой набор волн со всеми возможными ориентациями векторов Е и Н. Плоскополяризованный свет можно получить, пропуская свет через поляризатор, например через поляроид или призму Николя ( Рис. 10). Плоскополяризованный свет обладает такими же свойствами, как и обычный свет. При прохождении через вещество он преломляется (изменяется скорость распространения) и поглощается (уменьшается амплитуда вектора Е ). Преломление света характеризуется показателем преломления n, а поглощение молярным коэффициентом экстинкции e. При взаимодействии поляризованного света с оптически активными молекулами, наряду с вращением плоскости поляризации, будет обнаруживаться и преломление, и поглощение света. Причем, коэффициенты преломления и поглощения, будут различаться в зависимости от направления вращения плоскости поляризации. Плоскополяризованный свет обладает соответствующими коэффициентами n и e для правовращающей (nR и eR) и левовращающей (nL и eL) компонентов света. Любое оптически активное соединение будет характеризоваться соответствующими коэффициентами nL и eL, eL , eR при пропускании поляризованного света определенной длины волны. Величина вращения плоскости поляризации (угол поворота al) при этом будет зависит от соотношения коэффициентов nL и eL, от концентрации молекул с, от длины оптического пути d (толщины раствора) и от длины волны l падающего света:
al = 180° d(nL - eL)/l
В практической работе используются показатель удельного вращения [a]l
[a]l = al/ d с
и показатель молярного вращения М]l
[М]l = al М/100 d с
где al - угол поворота (град); d – длина оптического пути (дм); с – концентрация (г\мл); М – молекулярная масса (г/моль).
Зависимость оптического вращения выраженного в виде al , [М]l или [a]l , от длины волны поляризованного света называется спектром дисперсии оптического вращения ( спектр ДОВ). Приборы, которые регистрируют спектры ДОВ, называются спектрополяриметрами.
Поглощение поляризованного света оптически активным веществом характеризуется молярным коэффициентом экстинкции eL , eR . В результате неодинакового поглощения право и левовращающей компоненты света линейно поляризованный свет превращается в эллиптически поляризованный свет (Рис. 11). Это означает, что амплитуды колебания L , и R –волн будут изменяться в зависимости от угла поворота. В этом случае для характеристики взаимодействия света с веществом вводится показатель эллиптичность ql вещества
ql = 180° d(eL - eR )/l
Молярная эллиптичность, [q]l выражается следующей формулой:
[q]l = М ql/10 dс,
где ql -измеренная эллиптичность в граду; М - молекулярная масса;
Часто молярную эллиптичность вычисляют по следующей формуле:
[q]l = 3300 (eL - eR )
Кривая описывающая зависимость эллиптичности или молярной эллиптичности от длины волны, называется спектром кругового дихроизма( спектр КД). Приборы, регистрирующие такой спектр, называются КД-дихрографами. Схематичное изображение устройства этого прибора представлено на рисунке 12.
Рис. 8. Схема спектрополяриметра и КД-дихрографа (Фрайфельдер,464 с; Костюк,68 с)
1- источник свет; 2- монохроматор; 3 – поляризатор; 4 – кювета с оптически активным веществом; 5- анализатор; 6 – фотоэлектронный умножитель; 7- электронная система регистрации спектров.
ДОВ-спектрометрию и КД- дихрографию используют для определения высших структур макромолекул. Наибольшее применение эти методы нашли при установлении вторичной структуры белков. Точность этого метода можно сравнить с рентгеноструктурным анализом, а трудоемкость значительно меньше ( табл. 3). Для получения спектров ДОВ и КД требуется несколько часов, а на проведение рентгеноструктурного анализа требуются недели. Для определения вторичной структуры белковой молекулы, измеренные спектры ДОВ и КД, сравнивают со спектрами стандартных (маркерных) полипептидов с известной структурой, заложенных в память компьютера. В частности, основными стандартами для белков являются три формы поли- L- лизина: a-спираль, b-форма и беспорядочный клубок.
Таблица 1 Содержание спиральных структур (%) в молекулах белков по результатам рентгеноструктурного анализа и измерения КД-спектра (Chen, Yang, Martinez, 1972)
|
Белок |
КД-дихрография |
Рентгеноструктурный анализ |
|
Миоглобин |
77 |
77 |
|
Лизоцим |
29 |
29 |
|
РНК-аза |
18 |
19 |
|
Папаин |
21 |
21 |
|
Лактатдегидрогеназа |
31 |
29 |
|
a-химотрипсин |
8 |
9 |
|
Химотрисиноген |
9 |
6 |
Кроме определения вторичной структуры белковых молекул, измерение ДОВ - и КД –спектров позволяют определить в динамике:
- Изменения структуры белка при связывании с другими молекулами ( фермент-субстрат, фермент-ингибитор, антиген-антитело и другие).
- Денатурацию и ренатурацию молекул белков и НК.
- Образование пространственной структуры макромолекул, т.е. образование вторичной, третичной и четвертичной структур.
- Переход одноцепочечных полинуклеотидов в двухцепочечные и наоборот .
- Связывание т-РНК с аминокислотами.
ЯМР-спектроскопия, ЭПР-спектроскопия.
Ядерный магнитный резонанс (ЯМР) в настоящее время является широко используемым методом для изучения структуры биополимеров, о взаимодействиях между молекулами и о молекулярном движении. Рассмотрим теоретические основы этого метода на примере ЯМР для ядер атомов водорода 1Н.
Кроме заряда и массы, протон обладает механическим угловым моментом или спином I. Вращение заряженной частицы порождает магнитное поле; этот заряд можно представить как точечный магнит, ориентированный вдоль оси вращения. Напряженность этого магнитного поля выражается как магнитный момент µя. Подобно стержневому магниту, имеющему северный и южный полюс, µя имеет направление. Протоны схематически можно представить в виде микроскопических магнитных стрелок. При отсутствии внешнего магнитного поля протоны имеют хаотическое распределение. При наложении внешнего магнитного поля с напряженностью Н0 возникает взаимодействие между магнитным моментом протона µя и Н0. Энергия этого взаимодействия равна:
Е = gя bя I Н0
где gя - ядерный g - фактор bя – ядерный магнетон
Для протона ядерное спиновое квантовое число I составляет +1/2, или – 1/2. Во внешнем магнитном поле Н0 возможны две ориентации протонов: магнитные стрелки ориентируются по полю (параллельно линиям магнитного поля) с энергией E1 = - 1/2gя bя H0 ,
или против поля (антипараллельно линиям магнитного поля ) с энергиейE2 = + 1/2gя bя H0 ,
Разность энергий между уровнями равна
DЕ = Е2 - E1 = gя bя H0 ,
Между энергетическими уровнями ядер Е2 и E1 возможны переходы. При поглощении энергии электромагнитного излучения в области радиочастот ядрами происходит переход с одного уровня на другой. При наложении на систему ядер с различной ориентацией переменного магнитного поля (перпендикулярно постоянному магнитному полю Н0) происходит поглощение энергии волны определенной частоты v0.
v0 = gя bя H0/h , где h – постоянная Планка.
Поглощение энергии переменного магнитного поля ядрами атомов называют ядерным магнитным резонансом. Поглощенная энергия тратится на изменение ориентации ядер, т.е изменение спина ядра. Для измерения ЯМР используются ЯМР-спектрометры (Рис. 1). Этот прибор состоит из мощного электромагнита, который создает постоянное магнитное поле H0. Между полюсами магнита которого поле H1 с частотой до 108 Гц , натравленное перпендикулярно H0. Для достижения резонанса изменяют частоту переменного магнитного поля. При определенной частоте магнитные моменты ядер меняют ориентацию, происходит резонансное поглощение энергии переменного магнитного поля. Резкое изменение магнитного поля фиксируется детектором (катушка, в которой индуцируется электрический ток).
Любое ядро, например, протон, в магнитном поле может совершить только один переход. Спин протона может составлять или +1/2, или – 1/2 .Соответственно, спектр магнитного резонанса ядра должен состоять только из одной резонансной линии. Однако это не так, потому что ядра окружены электронами, и наложенное магнитное поле индуцирует также циркуляцию и этих электронов. Движущиеся электроны сами создают магнитное поле, которое также оказывает влияние на ориентацию ядра. Таким образом, наблюдаемая резонансная частота ядер определенных атомов зависит от их окружения, т.е. от структуры молекулы. Ценность ЯМР-спектроскопии обусловлена именно этим эффектом окружения, так как в молекуле резонансная частота определенного ядра одного и того же химического элемента, будет зависеть от химической группы, к которой принадлежит ядро. Например, резонансная частота протонов метильной группы будет отличаться от частоты протонов аминогруппы. Более того, частота протонов метильной группы толуола будет отличаться от частоты метильной группы уксусной кислоты. Такое смещение резонансной частоты, обусловленное химическим окружением, называется химическим сдвигом.
Для измерения химических сдвигов в кювету с исследуемым веществом вводят эталонное вещество – стандарт. В качестве стандарта часто используют тетраметилсилан (СНз)4Si. Это вещество имеет 12 эквивалентных протонов, которые дают одну резонансную линию. Этой резонансной линии приписывают произвольную величину Н0 или v0 и выражают химический сдвиг как смещение от этой величины. Величину смещения от эталона выражают в виде безразмерных единиц - миллионных доля (м. д .).
м. д. = (Нобр - Нэт ) 106/ Н0
где Нобр и Нэт –резонансная напряженность магнитного поля для образца и стандарта, соответственно.
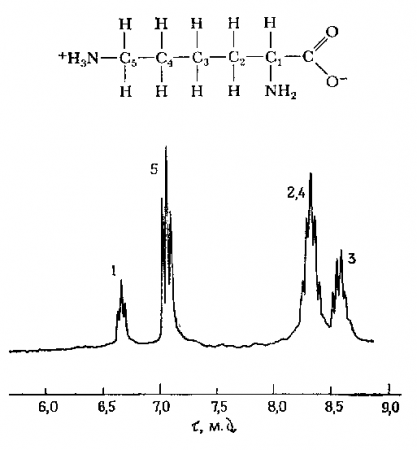
Преимущество такой безразмерной шкалы состоит в том, что химические сдвиги не зависят от действительной величины Н0 или от частоты переменного радиомагнитного поля и поэтому можно сравнивать спектры, полученные на разных ЯМР-спектрометрах. На рис. 10 представлен протонный спектр аминокислоты лизина, на котором видно несколько резонансных линий протонов, и влияние химической группы на ЯМР-сигнал.
Рис. 9. Блок-схема ЯМР-спектрометра:
1–образец; 2–магнит постоянного поля: 3–генератор переменного поля; 4 - генератор электромагнитного поля; 5 – катушка для передачи электромагнитного поля с частотой v; б–приемная катушка; 7–система регистрации сигнала ЯМР
ЯМР-томография. Вода в большом количестве входит в состав большинства биологических объектов. Основным ЯМР- сигналом биологических структур является сигнал протонного магнитного резонанса молекул воды. Интенсивность сигнала на данной частоте будет характеризовать относительное количество воды в ткани, которая находится в области определенного значения магнитного поля. Создавая в биологическом объекте градиент магнитного поля, можно получить спектр ЯМР протонов молекул воды. Профиль этого спектра будет определяться относительным содержанием молекул воды в той или иной части объекта. При помощи ЯМР-томографа биологический объект просвечивают во всех направлениях в магнитном поле. Затем с помощью компьютерного анализа воссоздают изображения по полученным проекциям. Таким образом, ЯМР-томография обеспечивает возможность изучения различных частей биологического объекта на основе различий амплитуды сигнала ЯМР в разных частях образца.
Рис. 10. ЯМР-спектр лизина, растворенного в тяжелой воде. (Фрайфельдер, с.486)
А) структурная формула лизина
Б) Спектр ЯМР молекулы лизина.
1,2,3,4,5 – номера атомов углерода, у которых находятся протоны, дающие данную группу линий
t - химический сдвиг в м.д.
Таким методом определяются размер и положение областей в организме, различающихся по содержанию воды. Например, можно определить размер и положение внутренних органов, инородных тел, попавших в организм. Этот метод с успехом используются для определения размеров и локализации опухолей в организме человека. ЯМР-томография имеет большое преимущество перед рентгеновской томографией, так как радиочастотное электромагнитное облучение не вызывает повреждений биологического объекта.
Электронный парамагнитный резонанс (ЭПР)
Явление ЭПР состоит в резонансном поглощении энергии электромагнитного поля парамагнитным веществом, помещенным в постоянное магнитное поле. Однако не все электроны могут быть исследованы при помощи метода ЭПР. Большинство химических соединений состоит из атомов с заполненными электронными оболочками, в которых все электроны спарены вследствие антипараллельной связи между ними. В соответствии с принципом Паули в результате попарного взаимодействия электронов их собственные спиновые магнитные моменты взаимно скомпенсированы, а суммарный магнитный момент равен нулю.
ЭПР-поглощение определяется магнитными свойствами вещества, т. е. магнитными свойствами электронов и ядер атомов..
Электрон обладает и собственным механическим вращением – спином и связанным с ним магнитным моментом. Условием возникновения ЭПР является наличие у частиц исследуемого образца некомпенсированных магнитных моментов, обусловленных спином неспаренных электронов. В системах с нечетным числом неспаренных электронов каждый электронный уровень вырожден по спину, по крайней мере дважды, т. е. уровни, характеризующиеся положительным и отрицательным значением магнитного квантового числа электрона m.s (например +1/2 и – 1/2), не отличаются по энергии.
В отсутствие внешнего магнитного поля все электроны парамагнитного вещества имеют произвольную ориентацию спина и обладают одинаковыми энергиями, т. е. наблюдается вырождение энергетического уровня (рис. 41, а). При помещении образца, обладающего парамагнетизмом, в постоянное магнитное поле вырождение снимается, т. е. появляются энергетические уровни, связанные с разрешенными ориентациями элементарных магнитных моментов электронов (рис. 41, б). Промежуточные ориентации спинов относительно магнитного поля запрещены условиями квантования.
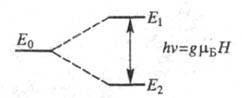
Рис. 11. Схема расщепления энергетических уровней неспаренных электронов при наложении внешнего магнитного поля при отсутствии сверхтонкого взаимодействия.
При наложении внешнего магнитного поля электронные уровни расщепляются на два подуровня в соответствии со значением спиновых чисел +½ и – ½ с разницей в энергии
DE=gbH,
где H – напряженность магнитного поля; b– магнетон Бора, равный 9,274 • 10-24 Дж • Тл-1.
На рис. 42 представлена схема расщепления энергетических уровней неспаренных электронов (спиновое квантовое число системы s = ½) при наложении внешнего магнитного поля. При этом энергия частиц, спины которых ориентированы по полю, на ½ gbH меньше энергии частиц в отсутствие внешнего магнитного поля. Энергия частиц, спины которых ориентированы против поля на 1/2 gbH, превышает значение в нулевом поле. Следовательно, разность энергий уровней равна gbH. Электроны в подсистемах Е1 и Е2 возникших во внешнем магнитном поле, почти равномерно распределяются по двум уровням энергии с незначительным преобладанием электронов со спином, ориентированным по полю.
Между двумя уровнями возможны энергетические переходы, в результате которых ориентация спинов будет изменяться на противоположную. Согласно принципам квантовой механики, переходы между энергетическими состояниями могут быть вызваны поглощением кванта hv. Если на спиновую систему, находящуюся в постоянном магнитном поле, воздействовать переменным сверхвысокочастотным электромагнитным полем с частотой v и энергией квантов hv, то при условии резонанса
hv = DЕ = gbH
индуцируются переходы между указанными энергетическими уровнями, т. е. происходит обращение спинов. При переходе с нижнего Е1 уровня на верхний Е2 происходит поглощение энергии электромагнитного поля; одновременно с такой же вероятностью осуществляются переходы с уровня Е2 на уровень Е1 с испусканием энергии. Как правило, поглощение превышает индуцированную эмиссию. Общее число неспаренных электронов в системе и разница в заселенности электронами двух энергетических уровней определяют интенсивность наблюдаемого сигнала ЭПР.
Измерение спектра ЭПР вследствие резонансных переходов электронов можно проводить двумя способами: 1) изменять напряженность магнитного поля Н при фиксированном значении частоты v; 2) изменять v при фиксированном значении Н. На практике ЭПР-спектрометры работают на фиксированной частоте v излучения при изменении Н.
Как и ЯМР-спектрометр, ЭПР-спектрометр состоит из электромагнита, источника СВЧ-излучения и электронной системы регистрации сигнала. Но поскольку ядерный магнетон более чем на три порядка меньше магнетона Бора, то при данной напряженности магнитного поля Н резонансная частота v для неспаренного электрона обычно в 103 раз превышает частоту, на которой работают ЯМР-спектрометры. Если эксперименты по ЯМР проводятся на частотах в диапазоне мегагерц (106 Гц), то ЭПР-спектрометры работают в диапазоне гигагерц (109 Гц).
Основными параметрами сигнала ЭПР являются фактор спектроскопического расщепления (g-фактор), интенсивность (количество неспаренных электронов в образце), ширина и форма линии.
Фактор спектроскопического расщепления характеризует положение линии в спектре ЭПР, определяемое тем, насколько свойства неспаренных электронов, ответственные за поглощение энергии в данном веществе, близки к свойствам свободного электрона, магнетизм которого обусловлен только спином, а g-фактор равен 2,0023. Для большинства парамагнитных центров g-фактор отличается от значения 2,0023 в сторону, как уменьшения, так и увеличения.
Например, сигналы ЭПР, обусловленные низкоспиновым состоянием гемового железа цитохрома Р-450 имеют g1 = 2,42, g2 = 2,25 и g3 =1,91. Восстановление этой молекулы переводит атом железа высокоспиновую форму со значениями g1 = 6,1 и g2 = 2,0 в спектре ЭПР.
Для парамагнитных центров, содержащих магнитные ядра, в спектре ЭПР возможно наблюдение сверхтонкой структуры (СТС), которая возникает в результате взаимодействия неспаренных электронов с магнитными моментами ядер. Аналогично электронным спинам, ядерные магнитные моменты, ориентируются в магнитном поле дискретно (либо вдоль внешнего магнитного поля, либо против него). Ядра многих атомов обладают спином и, следовательно, собственным магнитным моментом, который по абсолютной величине на три порядка меньше магнитного момента электрона. Количество компонентов сверхтонкой структуры определяется значениями ядерного спина данного атома по формуле 2I + 1, где I– значение ядерного спина атома. Следовательно, взаимодействие электрона с ядром приводит к расщеплению каждого электронного уровня энергии на 2I+ 1 уровней. Вследствие этого резонансное поглощение также расщепляется на 2I+ 1 равноудаленных линий одинаковой интенсивности.
С помощью метода ЭПР показано, что биологические системы животного и растительного происхождения содержат свободные радикалы, которые представляют собой молекулу или ее компоненты, имеющие неспаренный электрон. Свободные радикалы обладают парамагнитными свойствами благодаря и ее компенсированным магнитным моментам неспаренных электронов.
Метод ЭПР нашел эффективное применение для изучения молекулярных переносчиков электроннотранспортной цепи мембран митохондрий, включающих НАДН, флавины, кофермент Q10, железосерные центры, цитохромы в, с1,c, а также цитохром с-оксидазу. В митохондриях различных органов при низких температурах ( -200 С) регистрируется сигнал ЭПР с g-фактором 1,94, который обусловлен комплексами негемового железа в восстановленной форме.
ЭПР-спектроскопия получила дальнейшее свое развитие вследствие применения спиновых меток, синтезированных соединений, содержащих парамагнитный центр. При исследовании биологических молекул в качестве спиновых меток широко используют нитроксильные радикалы, которые ковалентно связываются молекулами (N'–О, которая содержит неспаренные электроны). Если парамагнитный радикал связывается с биологической молекулой электростатическими силами или гидрофобными взаимодействиями, то такой радикал называется спиновым зондом.
Интерпретация интенсивности, ширины и формы линий спектра ЭПР спиновой метки, введенной в биологическую структуру, дает информацию о физических и физико-химических параметрах микроокружения нитроксильного радикала.. Определение спектра ЯМР позволяет судить о фазовых переходах в липидном бислое мембраны и других средах. Так, параметр упорядоченности для липидов в жидком состоянии в несколько раз выше, чем в твердом состоянии. Снижение вязкости мембран приводит к уменьшению значения этого параметра.
Благодаря применению спиновых меток и зондов получены новые данные о строении и функционировании субклеточных структур, о липидах и белках, о липид-белковых взаимодействиях в мембранах.
Примеры использования ЯМР и ЭПР –спектроскопии:
1. Состояние молекул белков и липидов при фазовых переходах липидов мембран, белок-липидные взаимодействия
2. исследование свойств активных центров ферментов, роли кофактора в ферментно-субстратном связывании
3. Изменение структуры т-РНК при спаривании оснований
4. Измерение расстояния между атомными группировками, содержащие различные свободные радикалы